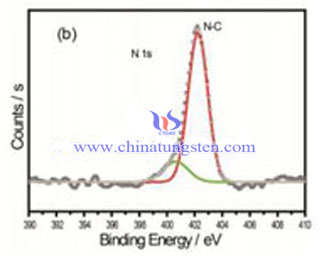
Acide tungstique XPS
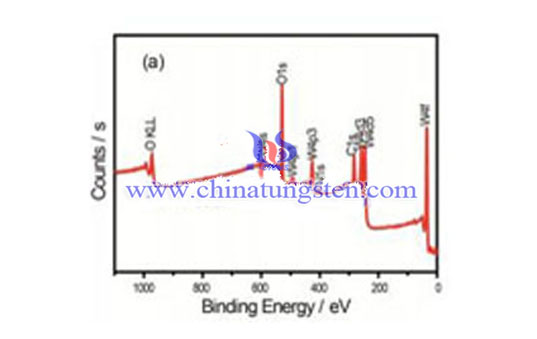
L'acide tungstique XPS est une technique d'analyse chimique de surface, de spectroscopie quantitative, utilisée pour tester des éléments, la formule empirique de tungstique ainsi que les états chimique et électronique des éléments de tungstène. Les spectres XPS sont obtenus en irradiant un matériau avec un faisceau de rayons X tout en mesurant simultanément l’énergie cinétique et le nombre d’électrons qui s'échappent des 0 à 10 nm supérieurs de l’acide tungstique analysé. Le XPS nécessite des conditions de vide poussé (P ~ 10−8 millibar) ou ultra poussé (UHV; P < 10−9 millibar), bien qu’un domaine de développement actuel soit le XPS à pression ambiante, dans lequel les échantillons sont analysés à des pressions de quelques dizaines de millibars.
Le XPS peut être utilisé pour analyser la chimie de surface d’un matériau dans son état d’origine, ou après un traitement, par exemple: fracturation, coupure ou grattage à l’air ou à ultra-haute tension pour exposer la chimie en vrac, Gravure par faisceau ionique pour éliminer une partie ou la totalité de la contamination de surface (avec une gravure ionique douce) ou pour exposer intentionnellement des couches plus profondes de l'échantillon (avec une gravure ionique plus étendue) lors du profilage en profondeur du système XPS, exposition à la chaleur pour étudier les modifications chauffage, exposition à des solutions ou à des gaz réactifs, exposition à un implant à faisceau ionique, exposition à la lumière ultraviolette.XPS est également connu sous le nom de ESCA (spectroscopie électronique pour analyse chimique), une abréviation introduite par le groupe de recherche de Kai Siegbahn pour souligner les informations chimiques (plutôt que simplement élémentaires) fournies par la technique. En principe, XPS détecte tous les éléments. En pratique, utilisant des sources de rayons X typiques à l'échelle du laboratoire, le système XPS détecte tous les éléments de numéro atomique (Z) supérieur ou égal à 3 (lithium). Il ne détecte pas facilement l’hydrogène (Z = 1) ni l’hélium (Z = 2).